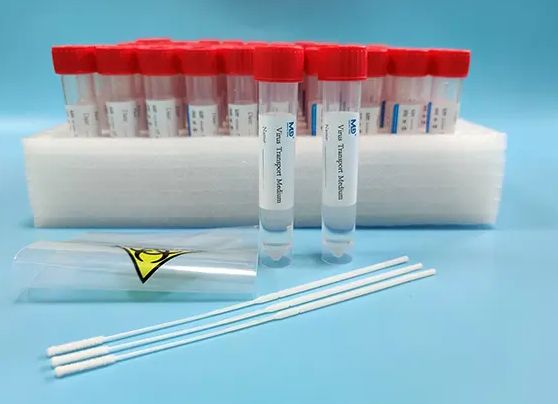
在公共衛生領域,一次性使用病毒采樣管、采樣器作為關鍵的醫療器械,其生產、銷售和使用需嚴格遵守國家醫療器械監督管理規定。隨著科技發展,部分與采樣配套的電子產品(如智能采樣信息管理終端、溫度監測設備等)也可能被納入醫療器械管理范疇。本文將系統解析這兩類產品辦理醫療器械產品備案(通常指第一類醫療器械備案)的完整流程與要點。
一、 核心概念與分類界定
- 產品定義:
- 一次性使用病毒采樣管/采樣器:用于采集人體樣本(如咽拭子、鼻拭子)并保存運輸,通常包含拭子、保存液及容器。屬于《醫療器械分類目錄》中“臨床檢驗器械”或“醫用耗材”范疇。
- 相關電子產品:若產品預期用途與疾病診斷、監測直接相關(如專用于樣本信息綁定、追蹤、溫控監測的設備),可能被判定為醫療器械。需根據《醫療器械分類規則》進行具體界定。
- 管理類別判定:
- 大多數常規的一次性病毒采樣管、采樣器屬于第一類醫療器械(風險程度低)。
- 若采樣管含有特殊保存液(如滅活型),或電子產品具有復雜診斷功能,則可能被歸為第二類。本文主要聚焦于第一類產品的備案流程。關鍵步驟是依據《醫療器械分類目錄》及國家標準,準確確定產品分類編碼和管理類別。
二、 備案前準備:主體資質與產品要求
- 備案主體資格:申請人必須是持有《營業執照》的企業,且經營范圍應包含醫療器械生產、銷售等相關內容。
- 產品技術研究:完成產品設計開發、驗證,確保符合強制性國家標準(如GB/T 14233.1等)及行業標準。
- 生產條件準備:具備與產品生產相適應的場地、設備、人員及質量管理體系(雖一類備案不強制體系認證,但需具備基本質量管控能力)。
三、 第一類醫療器械產品備案核心流程
第一步:產品檢驗
委托具有資質的醫療器械檢驗機構,依據產品技術要求進行全性能檢驗,取得合格的《產品檢驗報告》。
第二步:準備備案材料
主要材料清單如下:
- 第一類醫療器械產品備案表。
- 產品風險分析報告。
- 產品技術要求(明確性能指標、檢驗方法)。
- 產品檢驗報告。
- 臨床評價資料(一類產品通常可通過免臨床目錄、同品種對比等方式完成)。
- 產品說明書及最小銷售單元標簽設計樣稿。
- 生產制造信息(工藝簡述、場地等)。
- 證明性文件(營業執照副本、法人身份證復印件等)。
- 符合性聲明(聲明材料真實、產品合規)。
對于電子產品,還需提供軟件描述文檔(若含軟件)、電氣安全與電磁兼容性檢測報告等。
第三步:在線提交與窗口報送
通過國家藥品監督管理局“醫療器械注冊管理信息系統”在線填報并提交電子資料。按所在地省級藥品監督管理部門要求,報送紙質資料。
第四步:主管部門審核與備案憑證發放
藥品監督管理部門對資料進行形式審查,符合要求的,予以備案,當場發放《第一類醫療器械產品備案憑證》。不符合要求的,將一次性告知需補正內容。
第五步:生產備案銜接
取得產品備案憑證后,生產企業還需向所在地設區的市級藥監部門辦理第一類醫療器械生產備案,獲取《醫療器械生產備案憑證》,方可進行生產。
四、 特別注意事項
- 分類準確性:務必確保產品分類正確。分類錯誤可能導致備案無效甚至面臨處罰。
- 材料真實性:所有提交材料必須真實、準確、完整。虛假備案將承擔法律責任。
- 動態更新:備案信息(如產品名稱、技術要求、說明書等)發生變更時,需及時辦理備案變更。
- 電子產品特殊性:集成軟件的電子設備,其軟件安全性、數據合規性(如隱私保護)需重點評估并體現在技術文件中。
- 法規更新關注:密切關注國家藥監局及標準委發布的最新法規、標準及分類目錄動態,確保持續合規。
五、 建議
辦理一次性使用病毒采樣管、采樣器及相關電子產品的醫療器械備案,是一項專業、系統的合規工作。企業應:
- 先行論證:清晰界定產品屬性和管理類別。
- 精心準備:組建專業團隊或尋求合規咨詢機構協助,高質量準備備案資料。
- 規范流程:嚴格按照“產品檢驗→準備材料→提交備案→生產備案”的步驟推進。
- 體系保障:即便是一類產品,也應建立并運行基本的質量管理體系,確保產品安全有效。
通過完整、規范的備案流程,企業不僅能順利將產品推向市場,更能為公共衛生事業提供安全、可靠的技術產品保障。